Estas células protectoras puede, sin embargo, tener un rol en enfermedades como el alzhéimer y también en el dolor crónico
Através de la historia, a estas células se les ha pasado por alto, considerándose simples “soldados rasos” del sistema inmunológico.
Sin embargo, cada vez más científicos creen que la microglía puede tener un papel directo en el control de fenómenos que van desde la adicción hasta el dolor.
Algunos creen que incluso pueden desempeñar un rol clave en enfermedades como el alzhéimer, la depresión, la ansiedad, el Covid prolongado y la encefalomielitis miálgica (EM), también conocida como síndrome de fatiga crónica.
Pero, ¿qué son exactamente las microglías?
Esenciales para el cerebro
Hay dos tipos de células que componen el cerebro.
Las neuronas, también conocidas como células nerviosas, son los mensajeros del cerebro y envían información a todo el cuerpo a través de impulsos eléctricos.
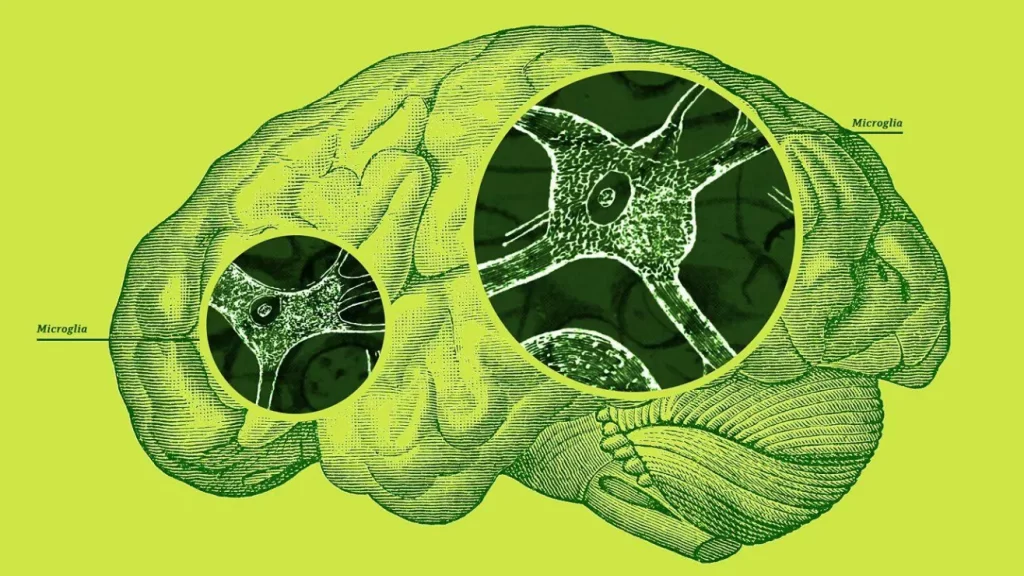
El otro tipo, las glías, componen el resto. Las microglías son el miembro más pequeño de la familia de las glías y representan aproximadamente el 10% de todas las células cerebrales.
Las pequeñas células tienen un “cuerpo” central de forma ovalada del que emergen delgados brazos en forma de zarcillo.
“Tienen muchas ramas que se mueven continuamente para inspeccionar su entorno”, dice Paolo d’Errico, neurocientífico de la Universidad de Friburgo, Alemania. “En condiciones normales, extienden y retraen estos procesos para percibir lo que sucede a su alrededor”.
Cuando funcionan bien, las microglías son esenciales para el funcionamiento saludable del cerebro. Durante nuestros primeros años, controlan el desarrollo del cerebro al podar las conexiones sinápticas innecesarias entre las neuronas.
Influyen en qué células se convierten en neuronas y reparan y mantienen la mielina, una capa protectora de aislamiento que recubre las neuronas, sin la cual la transmisión de impulsos eléctricos sería imposible.
Su función no termina ahí.
A lo largo de nuestra vida, las microglías protegen nuestro cerebro de las infecciones al buscar y destruir bacterias y virus.
Limpian los desechos que se acumulan entre las células nerviosas y eliminan y destruyen proteínas tóxicas deformes, como las placas amiloides (los grupos de proteínas que se cree que desempeñan un papel en la progresión de la enfermedad de alzhéimer).
No obstante, en determinadas circunstancias pueden volverse incontrolables.
La cara negativa
“Las microglías tienen dos caras: una buena y una mala”, afirma Linda Watkins, neurocientífica de la Universidad de Colorado en Boulder.
“Buscan problemas, actividad neuronal inusual y daños. Están atentas a cualquier tipo de problema dentro del cerebro, pero cuando se emocionan demasiado, pasan de ser los buenos vigilantes a los malos patológicos”.
¿Qué hace que se vuelvan rebeldes? Cuando las microglías detectan que algo no va bien en el cerebro, como una infección o una gran presencia de placas amiloides, pasan a un estado superreactivo.
“Se vuelven mucho más grandes, casi como globos grandes, y retraen sus apéndices y comienzan a moverse, devorando el daño como pequeños Pac-Mans”, dice Watkins.
Las microglías activadas también liberan sustancias conocidas como citocinas inflamatorias, que actúan como un faro, llamando a otras células inmunes y a la microglía a la acción.
Esta respuesta es necesaria para ayudar al cuerpo a luchar contra los invasores y las amenazas. Por lo general, después de una cierta cantidad de tiempo, las microglías vuelven a su estado “bueno”.
Pero a veces parece que la microglía puede permanecer en este estado de sobreexcitación mucho después de que el agente infeccioso haya desaparecido.
Ahora se piensa que estas microglías fuera de control son la causa de una variedad de enfermedades y afecciones modernas.
Las adicciones
Tomemos como ejemplo la adicción. Esta afección se ha considerado históricamente un trastorno del sistema neurotransmisor de la dopamina, y los desequilibrios de esta última son los responsables de que los pacientes tengan un comportamiento cada vez más centrado en las drogas.
Pero Watkins tiene una teoría diferente.
En un artículo académico publicado recientemente, Watkins y científicos de la Academia China de Ciencias sostienen que cuando una persona toma una droga, su microglía ve la sustancia como un “invasor” extraño.
“Lo que descubrimos a través de nuestra propia investigación fue que una variedad de opiáceos activan las células microgliales, y lo hacen al menos en parte a través de lo que se llama el ‘receptor tipo Toll’ (TLR)”, dice Watkins.
“Los receptores tipo Toll son receptores muy antiguos diseñados para reconocer objetos extraños. Se supone que están ahí para detectar hongos, bacterias y virus. Son los receptores del tipo ‘no soy yo, no estoy bien, no estoy bien’”.
Cuando la microglía detecta drogas como opiáceos, cocaína o metanfetamina, libera citocinas, lo que hace que las neuronas que están activas en el momento de tomar la droga se vuelvan más excitables.
Fundamentalmente, esto lleva a la formación de conexiones nuevas y más fuertes entre las neuronas y a la liberación de más dopamina, lo que refuerza el deseo y la ansiedad por la droga.
La microglía cambia la arquitectura misma de las neuronas del cerebro, lo que lleva a hábitos de consumo de drogas que pueden durar toda la vida.
La evidencia que apoya esta teoría es convincente.
Por un lado, los drogadictos ven un aumento de la inflamación y las citocinas inflamatorias en el cerebro. La reducción de la inflamación en animales también reduce el comportamiento de búsqueda de drogas.
El equipo de Watkin también ha demostrado que se puede evitar que los ratones busquen continuamente drogas como la cocaína bloqueando el receptor TLR y evitando la activación de la célula en sí.
El dolor
La microglia también podría desempeñar un papel importante en el dolor crónico, definido como el dolor que dura más de 12 semanas.
El laboratorio de Watkins ha demostrado que después de una lesión, la microglía de la médula espinal se activa, liberando citocinas inflamatorias que sensibilizan a las neuronas del dolor.
“Si se bloquea la activación de la microglía o de sus productos proinflamatorios, se bloquea el dolor”, afirma Watkins.
Según Watkins, la microglía podría explicar incluso otro fenómeno: por qué las personas mayores experimentan un marcado declive de sus capacidades cognitivas después de una cirugía o infección.
La cirugía o infección actúa como un primer golpe que “prepara” a la microglía, haciéndola más propensa a adoptar su condición de malos.
Después de la cirugía, a los pacientes se les suelen administrar opioides para aliviar el dolor, lo que lamentablemente activa de nuevo la microglía, lo que provoca una tormenta de inflamación que finalmente provoca la destrucción de las neuronas.
El campo de investigación está en sus inicios, por lo que estos primeros hallazgos deben tomarse con cautela, pero los estudios han demostrado que se puede prevenir el declive de la memoria posoperatoria en ratones bloqueando su microglía.
“Si me acerco a ti y, sin previo aviso, te doy una bofetada, me salgo con la mía la primera vez. Pero tú no me dejas salirme con la mía la segunda vez porque estás preparado, listo, en guardia”, afirma Watkins.
“Las células gliales son iguales. Con el envejecimiento, las células gliales se vuelven cada vez más preparadas y listas para reaccionar en exceso a medida que pasan los años. Y ahora que están en este estado óptimo, un segundo desafío como la cirugía las hace entrar en acción con mucha más fuerza que antes. Luego están los opioides, que son un tercer golpe”.
El daño a las neuronas
La microglía activada crónicamente puede engullir y matar neuronas directamente, liberar especies reactivas tóxicas que las dañan o iniciar una “poda excesiva” de las sinapsis, destruyendo la conexión entre las células nerviosas.
Todos estos procesos podrían, en última instancia, conducir a la confusión, la pérdida de memoria y la pérdida de la función cognitiva que caracterizan a la enfermedad.
En un estudio de 2021, d’Errico incluso descubrió que la microglía puede contribuir a la propagación de la enfermedad de alzhéimer al transportar las placas amiloides tóxicas por el cerebro.
“En las primeras etapas del alzhéimer hay regiones particulares en el cerebro que parecen acumular placas, como la corteza, el hipocampo y el bulbo olfatorio”, dice d’Errico.
“En las últimas etapas de la enfermedad hay muchas más regiones afectadas. Descubrimos que la microglía es capaz de internalizar la proteína amiloide y luego moverse a otra región antes de liberarla nuevamente”.
Algunos de los síntomas del alzhéimer, como la falta de memoria y la pérdida de la función cognitiva, son similares a los que se padecen por Covid prolongado, y es posible que la microglía errante también pueda estar detrás de la “niebla mental”.
Por ejemplo, uno de los principales factores que hacen que la microglía se vuelva rebelde es la presencia de una infección viral.
“La microglía activada de forma anormal puede iniciar una poda excesiva de sinapsis en el cerebro, y esto puede conducir al deterioro cognitivo, la pérdida de memoria y todos esos síntomas relacionados con el síndrome de niebla mental”, dice Claudio Alberto Serfaty, neurobiólogo de la Universidad Federal Fluminense, en Río de Janeiro, Brasil, quien resumió la evidencia de esta teoría en un artículo reciente.
La esperanza es que esta nueva forma de pensar conduzca eventualmente a nuevos tratamientos.
Actualmente se están realizando ensayos clínicos de nuevos medicamentos para el alzhéimer que tienen como objetivo aumentar la capacidad de la microglía para destruir el amiloide.
Sin embargo, como ocurre con todos los medicamentos para este padecimiento, la estrategia funcionaría mejor en las primeras etapas de la enfermedad, antes de que se haya producido una muerte neuronal significativa.
En el caso de la adicción, una idea es sustituir la microglía errática que ha dejado de funcionar correctamente por la microglía “normal” presente en el cerebro de quienes no consumen drogas.
Este concepto, conocido como reemplazo de microglía, implica injertar la célula en regiones específicas del cerebro mediante un trasplante de médula ósea.
No obstante, este enfoque resultaría difícil. Después de todo, la microglía activa es necesaria para combatir las infecciones; de hecho, es vital para el funcionamiento del cerebro.
“En teoría, sí podría funcionar, pero hay que tener en cuenta que no se quiere alterar la microglía en todo el cerebro, sino que tendría que estar localizada”, afirma Watkins.
“Microinyectar microglía en áreas específicas del cerebro sería muy invasivo. Por eso creo que tenemos que buscar algo que sea seguro para ese tipo de tratamiento”, agrega.